Impacts des systèmes de culture sur la teneur en glyphosate et en acide aminométhylphosphonique et sur la communauté microbienne des sols de grandes cultures au Québec (Canada)
par
William Overbeek 1,*,Marc Lucotte1 ,Joël D’Astous-Page 2 ,Thomas Jeanne 2 ,Clara Broche 1 ,Matthieu Moingt 1 etRichard Hogue2
1GEOTOP et Institut des Sciences de l’Environnement, Université du Québec à Montréal, Montréal, QC H3C 3P8, Canada
2Institut de Recherche et de Développement en Agroenvironnement (IRDA), Québec, QC G1P 3W8, Canada
*Auteur à qui la correspondance doit être adressée.
Agronomie 2024 ,
14 (4), 686 ;
https://doi.org/10.3390/agronomy14040686
Soumission reçue : 28 février 2024 /
Révisé : 21 mars 2024 /
Accepté : 22 mars 2024 /
Publié : 27 mars 2024(Cet article appartient au numéro spécial
L’effet d’une gestion agricole appropriée sur la productivité des sols et des cultures durables )
Examiner les rapports Remarques sur les versions
Abstrait
L’utilisation d’herbicides à base de glyphosate (GBH) est omniprésente dans les grandes cultures du Québec, en dehors de la gestion biologique. Comme le glyphosate se dégrade généralement rapidement dans les sols agricoles, de l’acide aminométhylphosphonique (AMPA) est produit et persiste plus longtemps que le glyphosate. Des applications répétées de GBH année après année soulèvent des questions sur la pseudo-persistance du glyphosate et de l’AMPA dans les sols et sur leurs impacts possibles sur la communauté microbienne du sol. Cette recherche vise à comprendre l’influence des systèmes de culture et des propriétés édaphiques sur les teneurs en glyphosate et en AMPA ainsi que sur la diversité et la composition de la communauté microbienne du sol dans neuf champs de grandes cultures situés dans le sud du Québec (Canada) au cours des années 2019 et 2020. Teneurs moyennes du sol en glyphosate (0,16 ± 0,15 µg.g
−1 de sol sec) étaient inférieures à la teneur moyenne du sol en AMPA (0,37 ± 0,24 µg.g
−1 de sol sec). Les teneurs en glyphosate et en AMPA étaient significativement inférieures dans les sites cultivés en gestion biologique par rapport à la gestion conventionnelle. Pour les sites conventionnels, les doses cumulées de GBH ont eu un effet significatif sur la teneur en glyphosate du sol mesurée à la fin de la saison de croissance, mais pas sur la teneur en AMPA du sol. Les sites où les applications de GBH sont plus élevées semblent accumuler du glyphosate au fil du temps dans l’horizon du sol de 0 à 40 cm. La teneur en glyphosate et en AMPA du sol est inversement proportionnelle au pH du sol. La diversité alpha, la diversité bêta et le potentiel fonctionnel des communautés procaryotes et fongiques du sol n’ont pas été affectés par les doses cumulées de GBH, mais plutôt par les propriétés chimiques du sol, la texture du sol, la rotation des cultures et les apports de fumier.Mots clés:
pseudo-persistance du glyphosate ;
AMPA ;
herbicides à base de glyphosate ;
1. Introduction
La commercialisation de cultures résistantes au glyphosate au milieu des années 1990 a entraîné une augmentation importante de l’utilisation d’herbicides à base de glyphosate (GBH) [
1 ]. Le GBH peut être appliqué en pré- et post-levée sur les cultures résistantes au glyphosate [
2 ]. En 2021, le GBH était l’herbicide le plus utilisé représentant près de 50 % de tous les herbicides vendus au Québec, Canada [
3 ]. Le glyphosate a une affinité pour être adsorbé sur les particules du sol, bien qu’il puisse être transporté vers des profils de sol inférieurs en fonction des conditions météorologiques et des précipitations après l’application du GBH [
4 ,
5 ]. La capacité d’adsorption du glyphosate sur les particules du sol est influencée par la capacité d’échange de cations (CEC), la texture du sol, la teneur en P et Al, la quantité de carbone organique du sol et le pH [
6 ,
7 ,
8 ]. Les molécules de glyphosate stérilisées qui ne s’adsorbent pas sur les tissus végétaux ou les particules du sol migreront dans les eaux interstitielles du sol, où le glyphosate est sujet à la dégradation [
4 ]. La dégradation du glyphosate est principalement biologique, bien que des voies abiotiques telles que la photolyse et la thermolyse puissent dégrader le glyphosate, produisant une variété de métabolites, dont l’acide aminométhylphosphonique (AMPA) [
9 ,
10 ]. La biodégradation du glyphosate implique trois métabolites majeurs, l’AMPA, la sarcosine et l’acétyl-glyphosate [
11 ]. La voie qui produit l’AMPA est généralement favorisée par rapport aux deux autres voies dans les sols, avec environ 90 % des métabolites du glyphosate étant des molécules AMPA [
4 ]. La demi-vie du glyphosate se situe entre 1 et 197 jours, tandis que la demi-vie de l’AMPA se situe entre 23 et 958 jours dans les sols agricoles tempérés [
12 ]. Une fois dans le sol, l’AMPA est plus résistant à la biodégradation et a une affinité plus élevée pour les particules du sol que le glyphosate, ce qui augmente sa demi-vie dans le sol [
13 ,
14 ]. Néanmoins, les deux molécules ont des propriétés physico-chimiques similaires avec une solubilité élevée dans l’eau, une faible lipophilie et un très faible potentiel de volatilisation [
15 ,
16 ]. La principale différence entre les deux molécules est leur poids moléculaire (169,07 g·mol
−1 pour le glyphosate et 111,04 g·mol
−1 pour l’AMPA) [
17 ].L’agriculture de conservation gagne en popularité parmi les agriculteurs et les conseillers en cultures pour maintenir une productivité élevée des cultures tout en maintenant la communauté microbienne et les fonctions écosystémiques bénéfiques pour le sol, en réduisant les GES et en augmentant la séquestration du carbone et la résilience au changement climatique [
18 ]. Selon l’Organisation des Nations Unies pour l’alimentation et l’agriculture : « L’agriculture de conservation est un système agricole qui favorise une perturbation minimale du sol (c’est-à-dire sans labour), le maintien d’une couverture permanente du sol et la diversification des espèces végétales. Il améliore la biodiversité et les processus biologiques naturels au-dessus et au-dessous de la surface du sol, contribuant à une utilisation plus efficace de l’eau et des nutriments et à une production agricole améliorée et durable »[
19 ]. La production de grandes cultures au Québec, comme le maïs-grain, implique généralement des stratégies de désherbage mécanique ou chimique [
20 ]. Pour les producteurs adoptant les principes de l’agriculture de conservation tels que le semis direct et les cultures de couverture hivernales, le contrôle mécanique des mauvaises herbes est plus restrictif ou n’est pas recommandé, ce qui entraîne une dépendance à des doses d’application d’herbicides plus élevées pour contrôler les mauvaises herbes problématiques telles que les mauvaises herbes vivaces [
21 ]. L’utilisation de doses plus élevées de GBH pourrait poser problème en termes d’accumulation potentielle de glyphosate et d’AMPA dans les sols ou de dissipation dans les cours d’eau. Ceci est d’une grande pertinence puisque le glyphosate et l’AMPA ont été respectivement détectés dans 98,9 % et 93,3 % des échantillons d’eau des cours d’eau agricoles du Québec entre 2018 et 2020 [
22 ]. Le glyphosate et l’AMPA ont été détectés respectivement dans 42 % et 70 % des 45 sols agricoles québécois en 2014 [
23 ].Le séquençage à haut débit (HTS), également connu sous le nom de séquençage de nouvelle génération, a révolutionné l’étude des communautés microbiennes du sol. Comparé aux techniques telles que l’isolement basé sur la culture, l’électrophorèse sur gel à gradient dénaturant, l’électrophorèse sur gel à gradient de température, le polymorphisme de conformation simple brin et l’empreinte digitale par amplification de l’ADN, le HTS est à haut débit, moins cher et demande moins de main-d’œuvre [
24 ]. Avec HTS, l’identification taxonomique est effectuée sur la base de bases de données pour des parties spécifiques de gènes, par exemple, la région V4 de l’
ARNr 16S [
25 ],
ITS1 [
26 ] et
l’ARNr 18S [
27 ] pour les communautés procaryotes, fongiques et eucaryotes, respectivement. De plus, la réaction en chaîne par polymérase quantitative (qPCR) de régions spécifiques des gènes de l’ARNr pourrait être utilisée pour estimer la biomasse microbienne, tandis que la qPCR de gènes microbiens spécifiques pourrait également être utilisée pour quantifier des voies biologiques telles que la fixation du carbone [
28 ], la nitrification [
29 ] ou la dégradation des pesticides [
30 ], qui peut demander beaucoup de travail lors de l’analyse de plusieurs gènes. L’avènement de bases de données telles que l’Encyclopédie des gènes et des génomes de Kyoto (KEGG) permet l’attribution directe du potentiel fonctionnel aux communautés microbiennes identifiées via HTS [
31 ]. Néanmoins, HTS présente des limites, basées sur la qualité de la base de données utilisée pour les identifications des potentiels taxonomiques et fonctionnels. Par exemple, l’identification taxonomique fongique est limitée en raison de la variabilité intraspécifique des séquences
ITS1 [
32 ].Des enquêtes antérieures sur la communauté microbienne du sol après l’application de GBH n’ont montré aucun effet sur la diversité alpha ou sur la composition globale [
33 ,
34 ,
35 ,
36 ]. D’autre part, les techniques de culture utilisées dans l’agriculture de conservation, telles que le travail réduit du sol ou l’utilisation de cultures de couverture, sont connues pour augmenter considérablement la diversité alpha microbienne du sol et avoir un effet profond sur la composition de la communauté microbienne [
37 ,
38 ,
39 ]. Les effets interactifs des applications de GBH et des stratégies de systèmes de culture sur les communautés microbiennes du sol ont reçu peu d’attention jusqu’à présent [
33 ,
36 ]. Jusqu’à présent, les études se sont concentrées sur les différences dans les applications GBH des années précédentes [
36 ] ou sur les différences dans le régime de travail du sol (labour direct ou travail au ciseau) [
33 ] ; cependant, ces études ont utilisé des parcelles expérimentales avec des systèmes de culture contrôlés, en se concentrant sur un paramètre à la fois. À notre connaissance, il n’existe aucune enquête dans les champs des producteurs commerciaux où ces facteurs (historique d’application d’herbicides, régime de travail du sol, utilisation des cultures de couverture) varient tous d’un producteur à l’autre.Pour mieux comprendre les effets interactifs des variables de gestion qui définissent les systèmes de culture, tels que la rotation des cultures, les applications de fumier, le travail du sol et les doses d’application de GBH, sur la teneur en glyphosate et en AMPA et sur la diversité des communautés microbiennes dans les sols, nous avons échantillonné les sols sur neuf champs de grandes cultures pendant deux années consécutives. Nous avons émis l’hypothèse que les teneurs en glyphosate et en AMPA seraient liées aux doses de GBH appliquées au cours des années précédentes et aux propriétés du sol telles que la CEC, le pH et la teneur en phosphore. De plus, nous avons émis l’hypothèse que la diversité (richesse et composition) et la diversité fonctionnelle de la communauté microbienne du sol seraient influencées par la combinaison des applications de GBH, des propriétés du sol et des pratiques de gestion des systèmes de culture.
2. Matériels et méthodes
2.1. Sélection et description des sites
Neuf champs avec une rotation, dont du maïs en 2019 et du soja en 2020, ont été sélectionnés dans le sud du Québec (Canada). Les régions de la Montérégie-Est et du Centre-du-Québec représentent respectivement 62 % et 15 % des superficies en grandes cultures de la province (
Figure 1 ). Deux champs (sites H et I) sont gérés par le même producteur. La sélection des champs visait à établir un gradient de systèmes de culture allant des systèmes biologiques sans application de GBH et labour conventionnel aux systèmes sans labour avec des doses variables de GBH appliquées.
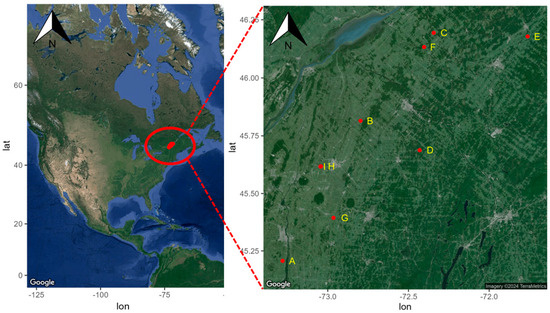
Figure 1. Localisation des sites d’étude (
n = 9) dans la province de Québec, Canada. Un cercle rouge et une lettre jaune désignent chaque site.Après la sélection des sites, une enquête a été envoyée aux agriculteurs propriétaires des neuf sites. L’enquête comprenait des questions sur la fréquence et l’intensité du travail du sol, la stratégie de fertilisation organique et minérale, les applications de pesticides, les informations sur les semis et la récolte des grandes cultures et l’utilisation des cultures de couverture. À partir des informations recueillies lors des enquêtes, les neuf sites ont été divisés en différents groupes en fonction de la rotation des cultures utilisée, de la fréquence d’application du fumier, de l’intensité du travail du sol et des quantités cumulées de GBH appliquées au cours des 4 dernières années (
Figure 2 ). Les rotations de cultures ont été divisées en quatre catégories : deux rotations étaient constituées de maïs en alternance avec du soja, l’une en gestion biologique et l’autre en gestion conventionnelle. Une autre rotation incluait le maïs et le soja comme cultures principales, ainsi que le seigle céréalier comme culture de couverture entre la récolte et l’ensemencement. La quatrième rotation comprenait le maïs, le soja et le blé comme cultures principales ; un mélange de cultures de couverture a été semé après la récolte du blé. La fréquence du fumier était basée sur les applications effectuées entre 2017 et 2020. Deux applications ou plus ont été classées comme fréquentes, une comme peu fréquente et aucune application comme jamais. Pour les applications GBH, le nombre de grammes de glyphosate pulvérisé par hectare entre 2017 et 2020 a été compilé (
Tableau 1 ) et classé en deux groupes (>5 400 g·ha
-1 et <5 400 g·ha
-1 ).
Le tableau 2 présente les principales propriétés physico-chimiques des neuf sites.
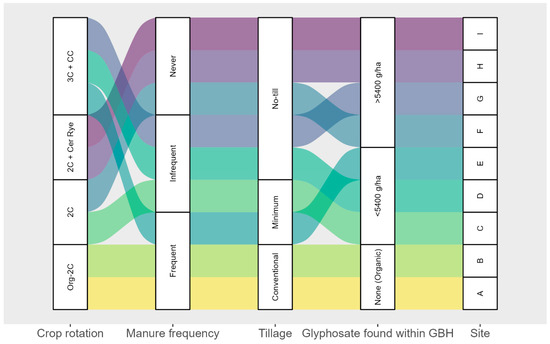
Figure 2. Classification des neuf sites en fonction de la rotation des cultures, de la fréquence d’application du fumier, du travail du sol et de l’application cumulée de GBH entre 2017 et 2020. Acronymes : Org-2c : système biologique avec maïs et soja (MS) ; 2C : système MS classique ; 3C + CC : système conventionnel MS-Blé et cultures de couverture (céréales, radis, pois) après récolte du blé ; 2C + Cer Rye : système conventionnel avec MS avec culture de couverture (seigle céréalier) après chaque récolte.
Tableau 1. Informations sur les applications GBH sur les neuf sites.
Tableau 2. Propriétés physico-chimiques de chaque site pour le profil de sol 0–20 cm. Les valeurs moyennes sont présentées pour les échantillons de 2019 et 2020. Les valeurs
p proviennent d’une analyse de variance pour chaque variable ; les lettres proviennent d’une comparaison post-hoc par paire utilisant l’ajustement de Tukey.
2.2. Échantillonnage du sol
En septembre 2019 et 2020, chaque site a été échantillonné aux quatre mêmes emplacements géoréférencés. Ces emplacements représentaient l’extrémité d’un carré dont le côté mesurait 50 m. À chaque endroit, des carottes de sol ont été collectées à deux profondeurs (0 à 20 cm et 20 à 40 cm) à l’aide d’un carottier manuel de 8 cm de diamètre. Chaque échantillon consistait en un composite de quatre carottes de sol (total de ± 500 g) prélevées à l’extrémité d’un carré d’une longueur d’un mètre de côté. Après l’échantillonnage, tous les sols ont été homogénéisés, immédiatement mis sur la glace et transférés à -20 °C jusqu’à un traitement ultérieur.
2.3. Analyse du contenu du glyphosate et de l’AMPA
Les extractions de glyphosate et d’AMPA ont été réalisées selon l’approche décrite par Samson-Brais et al. [
40 ]. Les sols ont été lyophilisés et broyés à l’aide d’un pilier et d’un mortier. Cinq grammes de sol passés à travers un tamis de 2 mm ont été mélangés à 40 ml d’une solution d’extraction composée de 34,5 ml de NH
4 OH (28 à 30 %) (Fisher Scientific, Ottawa, ON, Canada) avec 13,6 g de KH
2 OREN
4 (Fisher Scientific, Ottawa, ON, Canada) dans un volume total de 1 L [
41 ]. La solution a été mélangée sur une roue tournante à 300 tr/min pendant 45 min suivie d’une centrifugation à 3 500 tr/min pendant 20 min. Ensuite, 40 µL du surnageant ont été transférés et évaporés à sec sous flux d’azote. Les échantillons ont ensuite été dérivés en utilisant 1 ml d’anhydride trifluoroacétique (TFAA) (Sigma-Aldrich, Saint-Louis, MO, USA) et 500 µL de trifluoroéthanol (TFE) (Sigma-Aldrich, Saint-Louis, MO, USA), suivis de chauffer pendant une heure à 100 °C. Après chauffage, les échantillons ont été refroidis à température ambiante, évaporés à sec sous flux d’azote puis remis en suspension avec 1 mL d’acétate d’éthyle avant injection (0,5 μL). Un chromatographe en phase gazeuse Varian CP 3800 couplé à un détecteur à capture d’électrons et équipé d’une colonne Rxi-5Sil MS (Restek, Bellefonte, PA, USA) (30 m × 0,25 mm × 0,25 μm) a été utilisé pour la quantification du glyphosate et de l’AMPA. L’injecteur et le détecteur ont été maintenus respectivement à 280 °C et 300 °C. De l’hydrogène a été utilisé comme gaz porteur avec un débit de colonne de 1,4 mL.min
-1 . Le programme de température du four a commencé à une température initiale de 70 °C, maintenue pendant 1 min, suivie d’une augmentation de 1 °C·min
−1 jusqu’à 84 °C, suivie d’une augmentation de 4 °C·min
−1 à 120 °C, puis suivi d’une augmentation de 80 °C·min
−1 jusqu’à 250 °C maintenue pendant 7 min, pour une durée totale de fonctionnement de 32,63 min.Les limites de détection (LOD) et de quantification (LOQ) calculées sont respectivement de 0,03 et 0,09 µg·g
−1 sol sec pour l’AMPA et de 0,02 et 0,05 µg·g
−1 sol sec pour le glyphosate [
23 ]. Les échantillons avec des valeurs inférieures à la LOD sont ajustés à 0,02 µg.g −1
de sol sec pour l’AMPA et 0,01 µg.g
−1 de sol sec pour le glyphosate, tandis que les échantillons avec des valeurs comprises entre la LOD et la LOQ sont ajustés à 0,06 µg.g
− 1 terre sèche pour AMPA et 0,03 µg·g
−1 sol sec pour le glyphosate. Pour quantifier le glyphosate et l’AMPA, une courbe d’étalonnage a été réalisée avec une matrice d’échantillon comprenant un blanc et cinq étalons différents pour chaque lot d’échantillons (0, 0,1, 0,2, 0,3, 0,4 et 0,6 μg·g
-1 et 0, 0,2 , 0,4, 0,6, 0,8 et 1,2 μg·g
−1 pour le glyphosate et l’AMPA, respectivement). Les courbes d’étalonnage ont montré une bonne linéarité (r
2 > 0,95 ;
p < 0,0001) dans la plage de concentrations attendue.
2.4. Analyse des propriétés physico-chimiques du sol
Les propriétés physiques (granulométrie, texture) et chimiques (C et N totaux, MO, pH, CEC, éléments Mehlich-3) (
Tableau 2 ) ont toutes été déterminées au laboratoire d’analyse agroenvironnementale de l’IRDA. La teneur en humidité du sol a été déterminée par séchage au four à 105 °C pendant 24 h. Les échantillons de sol composites ont été séchés à l’air, homogénéisés et tamisés à <2 mm. Le C total et le N total ont été déterminés sur des sous-échantillons finement broyés (100 mesh) par combustion sèche à l’aide d’un analyseur LECO-CN828. Le pourcentage de matière organique a été déterminé par perte au feu à 375 °C [
42 ]. Le pH du sol a été déterminé à l’aide d’une suspension sol:eau 1:1 [
43 ]. Une procédure similaire a été utilisée avec une suspension sol: solution SMP 1: 1 pour déterminer le pH du tampon du sol [
44 ]. Les concentrations de P, K, Ca, Mg, Al, B, Cu, Fe, Mn, Zn et Na ont été déterminées à l’aide d’un spectromètre d’émission optique à plasma à couplage inductif (ICP-OES, Perkin Elmer Optima 4300DV, Shelton, CT, USA ) après extraction Mehlich 3 [
45 ]. La CEC a été obtenue en calculant les cations basiques et acides en utilisant les résultats extractibles Mehlich-3 K, Ca, Mg et Na et le pH du tampon du sol [
46 ]. Le taux de saturation en phosphore (ISP) a été calculé en divisant le Mehlich-3 P extractible par le Mehlich-3 Al extractible [
47 ].
2.5. Extraction d’ADN, séquençage et PCR quantitative d’ADN bactérien et fongique
Les extractions d’ADN ont été réalisées à l’aide d’un kit FastDNA Spin pour sol (MPBio, Irvine, CA, USA). Des échantillons de sol ont été ajoutés à des tubes contenant 1 mL du tampon de lyse et 1,4 g de la matrice de billes E fournie avec le kit. L’extraction de l’ADN a été réalisée conformément aux instructions du fabricant. Le culot d’ADN résultant a été mis en suspension dans 100 µL d’eau stérile de qualité moléculaire.La quantité et la qualité de l’extrait d’ADN ont été évaluées par spectrophotométrie à l’aide d’un biophotomètre (Eppendorf, Mississauga, ON, Canada) avec une cuvette G1,0 μ (Eppendorf, Mississauga, ON, Canada) avec des lectures à 260, 280, 230 et 320 nm. La région V4 du gène de
l’ARNr 16S des procaryotes (archées et bactéries) a été amplifiée à l’aide des amorces 515FB et 806RB [
25 ,
48 ]. Pour les champignons, les eucaryotes (champignons)
ITS1 a été amplifié à l’aide des amorces BITS-ITS1 et B58S3 [
26 ]. Pour les communautés eucaryotes, le gène eucaryote de
l’ARNr 18S a été amplifié à l’aide des amorces E572F et B-E1009R [
27 ]. Tous les gènes ont été amplifiés dans le cadre d’une PCR à double index en deux étapes conçue pour les instruments Illumina par la Plateforme d’analyses génomiques (IBIS, Université Laval, Québec, QC, Canada).Le séquençage de l’ADN a été réalisé par IBIS sur une plateforme Illumina MiSeq, selon les méthodes de Jeanne et al. [
49 ]. Les procédures utilisées pour l’amplification et le séquençage de l’ADN fongique étaient similaires aux procédures utilisées pour l’amplification de l’ADN procaryote. Les séquences obtenues ont été démultiplexées en fonction du tag utilisé. Le contrôle de la qualité des séquences et la construction du tableau des caractéristiques ont été réalisés à l’aide de QIIME2 [
50 ] et du plugin DADA2 [
51 ]. Les bases de données de référence SILVA 138 [
52 ] (communautés procaryotes et eucaryotes) et UNITE version 8 [
53 ] (communauté fongique) ont été utilisées pour l’identification taxonomique des variantes de séquence d’amplicons [
54 ].Les quantités totales de bactéries et de champignons ont été quantifiées selon l’approche mentionnée dans [
55 ]. En bref, les paires d’amorces Eub-338/Eub518 et FF390/FR1 ont été utilisées respectivement pour les bactéries totales et les champignons totaux. À partir des valeurs CT moyennes des échantillons, les unités d’amplification ont été dérivées à l’aide de régressions linéaires conçues par le Laboratoire d’écologie microbienne de l’Institut de recherche et développement en agroenvironnement (IRDA, Québec, QC, Canada) comme décrit dans [
56 ].Pour évaluer le potentiel fonctionnel de la communauté procaryote dans les échantillons de sol, des approches d’inférence métabolique Picrust2 [
57 ] ont été utilisées avec une base de données KEGG PATHWAY mise à jour (juillet 2022) [
31 ] et les numéros de classification enzymatique de MetaCyc (EC) [
58 ]. Les enzymes et les voies métaboliques liées au glyphosate comprenaient le thiO (EC : 1.4.3.19) [
59 ], le phnP (EC : 3.1.4.55), le phnN (EC : 2.7.4.23), le phnM (EC : 3.6.1.63), le phnJ (EC :4.7.1.1) et phnIGHL (EC:2.7.8.37) [
60 ], et la voie du shikimate (M00022), qui sont tous liés à la dégradation du glyphosate dans le sol ainsi que la voie du shikimate connue pour être affectée par le glyphosate. Potentiels fonctionnels des voies générales telles que le métabolisme du soufre (M00176 ; M00596 ; M00595), le métabolisme des phosphonates (Ko00440), la nitrification (M00175 ; M00528 ; M00530 ; M00531 ; M00804), la dénitrification (M00529 ; M00973) et la fixation du carbone (M00165 à M00173). ; M00374 à M00377 ; M00579 ; M00620) ont été calculés. Des variants représentatifs de la séquence d’amplicons (ASV) ont été utilisés à partir de l’analyse QIIME2 sans filtration, suivis du pipeline par défaut avec des abondances de familles de gènes d’entrée non stratifiées par organismes contributeurs. Ces valeurs ont été normalisées en soustrayant la valeur moyenne de l’échantillon de la voie et en divisant par l’écart type de l’échantillon.
2.6. Analyse des données en aval et analyse statistique
Toutes les analyses statistiques ont été réalisées en R 4.2.2 [
61 ]. Les quantifications du glyphosate et de l’AMPA ont été visualisées dans le package ggplot2. Les contenus en glyphosate et en AMPA ont été transformés en log pour une analyse statistique. Les impacts de l’année et de la profondeur d’échantillonnage ainsi que des applications de GBH sur les contenus en glyphosate et en AMPA ont d’abord été évalués à l’aide d’une ANOVA, suivis d’une comparaison par paire post-hoc à l’aide de la fonction TukeyHSD du package de statistiques. Les différences entre les teneurs en glyphosate en 2019 et 2020 pour chaque lieu d’échantillonnage ont été utilisées pour étudier la dissipation de la molécule et la relier aux changements dans les applications de GBH entre 2019 et 2020. Une approche similaire a été utilisée pour comparer la dissipation de l’AMPA au changement dans Application de GBH entre 2019 et 2020. La teneur en glyphosate et en AMPA du sol en 2014 a été collectée auprès de Maccario et al. [
23 ]. Une ANOVA suivie de la fonction TukeyHSD a été réalisée sur des valeurs transformées en log pour évaluer l’effet des années sur la teneur en glyphosate et en AMPA. Des régressions multiples ont été utilisées pour évaluer l’effet des applications cumulatives de GBH entre 2017 et 2020, le pH du sol, la CEC, la teneur en argile et le rapport ISP sur la teneur en glyphosate et en AMPA. Une première série de régressions multiples a été réalisée avec les sites organiques et conventionnels, tandis qu’une deuxième série de régressions multiples a été réalisée avec uniquement les sites conventionnels.Pour les communautés procaryotes, fongiques et eucaryotes du sol, le nombre de lectures a été normalisé à 12 500, 13 000 et 3 900 lectures, respectivement, en utilisant la fonction raréfier-même-profondeur du package phyloseq R [
62 ]. La diversité alpha a été mesurée par les indices Shannon et Chao1 avec la fonctionestimate_richness du package phyloseq [
63 ]. L’impact des applications cumulatives de GBH et des systèmes de culture sur les indices de diversité microbienne et la quantification a été analysé à l’aide d’un modèle mixte avec un modèle de régression multiple, incluant l’année d’échantillonnage et la profondeur comme covariables fixes et le site comme effet aléatoire. La diversité bêta a été évaluée par analyse des coordonnées principales (PCoA) avec dissimilarité de Bray – Curtis pour une ordination non supervisée de la communauté microbienne du sol.
64 ]. Des analyses de redondance basées sur la distance (db-RDA) ont été utilisées pour évaluer l’effet marginal de toutes les propriétés physico-chimiques du sol sur la composition des communautés microbiennes. Les propriétés du sol ayant des effets marginaux significatifs ont été incluses dans une autre db-RDA avec des variables de gestion des sols.
3. Résultats
3.1. Contenu du sol en glyphosate et AMPA
Les teneurs en glyphosate du sol se situent entre en dessous de la LD et jusqu’à 0,72 µg·g
-1 de sol sec, tandis que les teneurs en AMPA dans le sol se situent entre en dessous de la LD et jusqu’à 1,22 µg·g
-1 de sol sec (
Tableau 3 ). Globalement, 16 % et 28 % des échantillons de sol présentent respectivement des teneurs en glyphosate inférieures à la LOD et comprises entre la LOD et la LOQ. Ensuite, 10 % et 28 % des échantillons de sol ont des teneurs en AMPA inférieures à la LOD et comprises entre la LOD et la LOQ, respectivement.
Tableau 3. Teneurs moyennes du sol en glyphosate et en AMPA en 2019 et 2020 par rapport aux catégories d’application cumulatives de GBH entre 2017 et 2020.
3.1.1. Impacts de l’année d’échantillonnage et de la profondeur d’échantillonnage
La teneur en glyphosate et en AMPA du sol est liée de manière significative à la profondeur d’échantillonnage, à l’année d’échantillonnage et aux applications cumulatives de GBH (
p < 0,01). L’interaction entre l’année d’échantillonnage et la profondeur est significative pour la teneur en glyphosate (
p < 0,01), alors qu’elle n’est pas significative pour l’AMPA (
p = 0,66) (
Tableau 3 ).Les teneurs en glyphosate du sol en 2020 à 20–40 cm de profondeur sont significativement inférieures (
p < 0,01) à celles de 0 à 20 cm de profondeur pour les deux années et à 20–40 cm de profondeur en 2019. Aucune autre différence significative n’est observée entre la profondeur d’échantillonnage et année. Les teneurs en glyphosate des sols des sites conventionnels sont significativement plus élevées que celles des sites biologiques (
p < 0,01). Plus précisément, les teneurs en glyphosate du sol en 2019 dans les exploitations ayant pulvérisé plus de 5 400 g·ha
−1 entre 2017 et 2020 sont plus élevées que celles des exploitations ayant pulvérisé moins de 5 400 g·ha
−1 (
p <0,01).Les teneurs en sol AMPA sont significativement plus élevées en 2019 par rapport à 2020 (
p < 0,01). Les teneurs en AMPA sont plus élevées entre 0 et 20 cm de profondeur que entre 20 et 40 cm de profondeur (
p < 0,01). Il y a beaucoup plus d’AMPA dans les sols des sites conventionnels que dans les sols biologiques (
p < 0,01). Cependant, la différence de teneur en AMPA entre les exploitations ayant pulvérisé plus de 5 400 g·ha
−1 et les exploitations ayant pulvérisé moins de 5 400 g·ha
−1 n’est pas significative (
p = 0,95).Les sites A, B, D, G, H&I sont gérés par des producteurs dont les champs ont déjà été échantillonnés en 2014 par Maccario et al. [
23 ]. Une comparaison entre la teneur en glyphosate et en AMPA de 2014, 2019 et 2020 a été effectuée (
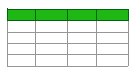
Figure 3 ). Les sites organiques (A et B) ne présentent aucune augmentation ou diminution des teneurs en glyphosate et en AMPA. L’AMPA n’est pas significativement différent d’une année à l’autre pour tous les sites conventionnels, sauf entre 2014 et 2019 pour les sites H et I. La teneur en glyphosate est significativement plus élevée pour les sites G et H&I, mais pas significativement plus élevée pour le site D. Par conséquent, les sites avec des applications GBH plus élevées entre 2017 et 2020 semblent présenter une augmentation significative de la teneur en glyphosate entre 2014 et 2019-2020.
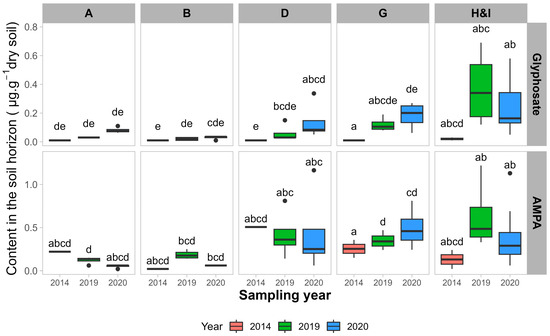
Figure 3. Teneurs du sol en glyphosate et AMPA dans les champs des producteurs ayant participé à la fois à cette expérience en 2019 et 2020 et à celle de Maccario et al. [
23 ] en 2014. Les sols ont été échantillonnés à une profondeur de 0 à 20 cm. Les lettres représentent une analyse post-hoc pour chaque molécule à l’aide de l’ajustement Tukey.Les changements dans la teneur en glyphosate du sol entre 2019 et 2020 dans la couche 0 à 20 cm sont corrélés aux changements dans les applications de GBH entre la moyenne de 2017 à 2019 et 2020 (
Figure S1 ). Cependant, cette corrélation n’est pas observée pour le glyphosate dans l’horizon 20-40 cm et l’AMPA dans l’horizon 0-20 cm. Les contenus en AMPA dans l’horizon de 20 à 40 cm présentent une corrélation négative avec l’application de GBH (
Figure S1 ).
3.1.2. Impacts des pratiques de gestion et des propriétés du sol
Une première série de régressions multiples incluant des sites biologiques et conventionnels montre une corrélation significative entre les applications de GBH sur le glyphosate (
p < 0,01) et les teneurs en AMPA (
p < 0,01) dans l’horizon de sol de 0 à 20 cm. En revanche, toutes les propriétés physiques et chimiques du sol, à l’exception du pH du sol, n’ont pas de corrélation significative (
Figure S2 ). Cette corrélation des applications de GBH est due aux sites biologiques qui n’ont eu aucune application de GBH entre 2017 et 2020, ainsi qu’à de faibles teneurs en glyphosate et en AMPA. Après avoir exclu les sites organiques des régressions multiples, l’effet des applications de GBH est significatif pour le glyphosate (
p = 0,02) mais non significatif pour la teneur en AMPA (
p = 0,85) (
Figure 4 ).
Figure 4. Valeurs des coefficients ainsi que leur intervalle de confiance à 95 % pour toutes les variables indépendantes dans les régressions multiples pour la teneur en AMPA (
à droite ) et en glyphosate (
à gauche ) pour un horizon de sol de 0 à 20 cm de sites conventionnels.En excluant les sites organiques des régressions multiples, les valeurs R carré ajustées des régressions sont de 50 % pour le glyphosate et de 19 % pour l’AMPA. Le pH du sol montre un effet négatif significatif sur la teneur en glyphosate (
p < 0,01) et en AMPA (
p < 0,01). La teneur en argile du sol montre un effet positif sur la teneur en glyphosate (
p = 0,03) mais pas sur la teneur en AMPA (
p = 0,59). La CEC du sol n’a pas d’effet significatif sur le glyphosate (
p = 0,22), mais un effet positif significatif sur la teneur en AMPA (
p = 0,02). L’ISP du sol a un effet négatif significatif sur la teneur en glyphosate (
p = 0,01) mais pas sur la teneur en AMPA (
p = 0,91).
3.2. Communauté microbienne du sol
Le séquençage des amplicons sur MiSeq des trois groupes microbiens a donné, après filtration, une moyenne de 27 788 (± 4 818) ; 28 740 (±7 809) ; et 4 819 (± 1 464) séquences par échantillon pour les procaryotes, les champignons et les eucaryotes, respectivement. En combinant tous les échantillons, la communauté procaryote contenait 17 400 ASV uniques, la communauté fongique contenait 17 500 ASV uniques et la communauté eucaryote contenait 6 000 ASV uniques.
3.2.1. Alpha-Diversité et Abondance
L’analyse des mesures de diversité alpha montre une forte corrélation entre Shannon, Chao1, les ASV observés et les mesures d’uniformité pour chaque communauté microbienne. Par conséquent, l’indice de diversité de Shannon a été utilisé pour évaluer la diversité alpha des communautés microbiennes, tandis que les résultats de quantification ont évalué l’abondance totale des procaryotes et des champignons (
Figure 5 ). L’indice de Shannon pour les communautés fongiques et eucaryotes n’est pas significativement affecté par la profondeur d’échantillonnage (
p > 0,05) ou l’année (
p > 0,10). En revanche, l’indice de Shannon procaryote est significativement impacté par l’année d’échantillonnage (
p < 0,001) avec une diversité plus élevée en 2020 par rapport à 2019, mais aucun effet significatif de la profondeur d’échantillonnage (
p = 0,19). La quantification des communautés procaryotes et fongiques est significativement influencée par l’année d’échantillonnage (
p < 0,001) et la profondeur d’échantillonnage (
p < 0,001). Pour les deux communautés microbiennes, les quantités totales sont plus élevées dans la couche de 0 à 20 cm. Pour les communautés procaryotes, la quantification est plus élevée en 2019 sur les sites A, B, C, D, G et H, tandis qu’elle est plus élevée pour les communautés fongiques en 2020 sur les sites C, D, F, G, H, I.
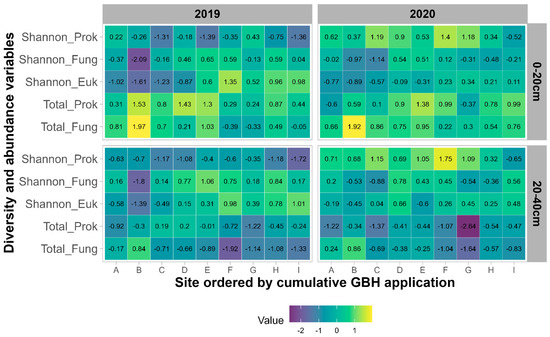
Figure 5. Valeur normalisée de l’indice de diversité de Shannon des communautés procaryotes (Shannon_Prok), fongiques (Shannon_Fung) et eucaryotes (Shannon_Euk) ainsi que quantification du total des bactéries (Total_Prok) et du total des champignons (Total_Fung) pour chaque site pour les années 2019 (maïs) et 2020 (soja) et les deux horizons (0-20 cm et 20-40 cm).Les applications cumulatives de GBH et la gestion des cultures ont un faible effet sur la diversité et la richesse des communautés microbiennes. La diversité de la communauté procaryote et fongique de Shannon n’est pas significativement affectée par les applications cumulatives de GBH (
p > 0,27) et les rotations des cultures (
p > 0,05). Les applications GBH ont un impact significatif sur la diversité eucaryote (
p = 0,02), avec une diversité eucaryote plus élevée dans les domaines recevant des applications GBH. Les applications cumulatives de GBH et les rotations des cultures n’ont pas d’impact sur la quantification des procaryotes et des champignons.
3.2.2. Bêta-Diversité
La composition des communautés microbiennes, notamment procaryotes, est fortement influencée par la texture du sol (
Figure 6 ). L’analyse PCoA montre que les communautés microbiennes trouvées dans les sols à texture grossière ont tendance à différer de celles des sols à texture fine, avec des différences marquées pour les communautés procaryotes et, dans une moindre mesure, pour les communautés fongiques et eucaryotes. Il est intéressant de noter que les communautés fongiques du sol à texture fine couvrent une grande partie de la parcelle d’ordination, ce qui indique que les communautés fongiques dans un sol à texture fine peuvent être très diverses par rapport aux communautés procaryotes, qui sont plus similaires dans un sol à texture fine (
Figure 6 ).
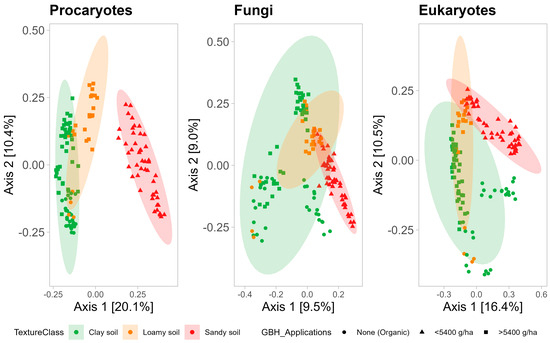
Figure 6. Analyse des coordonnées principales des communautés procaryotes (
à gauche ), fongiques (
au milieu ) et eucaryotes (
à droite ). Les couleurs des points représentent les groupes basés sur les applications cumulatives GBH entre 2017 et 2020. Les formes de points et les couleurs des ellipses représentent la texture du sol. Le seuil de signification des ellipses était de 0,05.À l’aide de db-RDA, un ensemble de variables de propriétés du sol (MO, Ca, Na, teneur en argile et teneur en sable) ont été identifiées comme ayant un effet significatif sur la composition des trois communautés microbiennes (
tableau supplémentaire S1 ). L’effet marginal de ces propriétés du sol sélectionnées est comparé à l’effet marginal des pratiques de gestion (
Tableau 4 ). Dans l’ensemble, la concentration en sodium a l’effet marginal le plus élevé pour toutes les communautés microbiennes, suivie par la teneur en argile et en sable, puis par la rotation des cultures, les apports de fumier et la teneur en calcium. Bien que la teneur en matière organique ait un effet marginal significatif lorsque l’on considère uniquement les variables environnementales (
Tableau supplémentaire S1 ), l’effet n’est pas significatif dans un modèle incluant des variables de gestion (
Tableau 4 ). Les doses d’application de GBH n’ont pas d’effet marginal significatif sur les communautés microbiennes du sol.
Tableau 4. Effet marginal de l’analyse de redondance basée sur la distance de chaque variable environnementale et de gestion sur les communautés microbiennes du sol.
3.2.3. Potentiel fonctionnel
Des outils tels que Picrust2 permettent de déduire différents potentiels fonctionnels, tels que les gènes impliqués dans la dégradation du glyphosate, ou des voies générales qui sont des processus importants dans le sol à partir des communautés microbiennes observées dans notre expérience (
Figure 7 ). Dans l’ensemble, l’année d’échantillonnage a un effet très significatif (
p < 0,001) sur tous les gènes et voies d’intérêt, avec des valeurs plus élevées en 2020 par rapport à 2019. L’horizon du sol n’a pas d’effet significatif pour tous les gènes, à l’exception des gènes liés. à l’opéron phn (phnIGHL, phnJ, phnM, phnN et phnP), pour lequel le potentiel était plus élevé dans l’horizon 0-20 cm que dans l’horizon 20-40 cm.
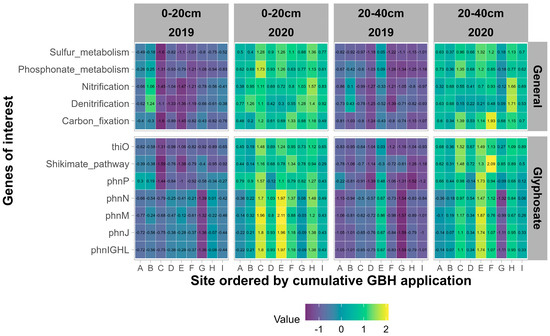
Figure 7. Potentiel fonctionnel normalisé des communautés procaryotes pour les gènes liés au métabolisme général (
en haut ) et les gènes liés au métabolisme du glyphosate (
en bas ) pour les deux années (2019 et 2020) et les deux horizons du sol (0-20 cm et 20-40 cm) .La texture du sol, exprimée en teneur en sable et en argile, a le plus d’effets à la fois sur les fonctions générales et sur les fonctions liées au glyphosate. Les rotations de cultures et les apports de fumier montrent un effet significatif sur l’opéron phn, à l’exception du phnP. Les apports fréquents de fumier ont un potentiel de phnM significativement plus élevé (
p = 0,044) par rapport aux apports peu fréquents de fumier. Les applications cumulatives GBH n’ont pas d’effet significatif sur les fonctions d’intérêt.
4. Discussion
4.1. Pseudo-persistance du glyphosate et de l’AMPA dans les sols
La pseudo-persistance des polluants est définie par l’ajout constant de nouvelles molécules qui reconstituent les molécules éliminées [
65 ]. Comme les GBH sont appliqués presque chaque année sur des sols qui ne sont pas sous gestion biologique, le glyphosate et l’AMPA pourraient être considérés comme des polluants pseudo-persistants dans ces sols [
66 ]. La pseudo-persistance du glyphosate et de l’AMPA dans les sols échantillonnés analysés est presque omniprésente, avec 84 % des échantillons contenant des niveaux détectables de glyphosate et 90 % pour l’AMPA. Les sites sans application de GBH depuis plus d’une décennie présentent des niveaux détectables de glyphosate et d’AMPA dans leurs sols. Les traces de glyphosate et d’AMPA dans les sites biologiques peuvent s’expliquer par l’épandage fréquent de fumier sur les champs biologiques. Comme le fumier ne doit pas nécessairement provenir d’animaux cultivés de manière biologique, il peut contenir des résidus de glyphosate et d’AMPA provenant de l’alimentation animale conventionnelle [
67 ]. Fuchs et coll. [
67 ] a épandu du fumier de volaille sur un champ qui n’a jamais reçu de GBH. Avec un taux d’épandage de fumier extrêmement élevé (36 MT·ha
−1 ), Fuchs et al. ont pu détecter 1,7 µg·g
−1 de sol sec de glyphosate dans un sol organique. Cette teneur en glyphosate est beaucoup plus élevée que toutes les mesures rapportées ici dans les champs biologiques et conventionnels, démontrant la capacité du fumier à importer du glyphosate et de l’AMPA dans les champs gérés biologiquement.Des expériences antérieures axées sur les sols de grandes cultures rapportent des niveaux de détection de glyphosate et d’AMPA légèrement inférieurs ou similaires dans les sols du Québec (42 % et 70 %), de l’Argentine (100 % pour les deux) et du Brésil (94 % et 100 %). respectivement [
23 ,
66 ,
68 ]. Le taux de détection plus faible enregistré au Québec a été observé dans les échantillons de sol prélevés en 2014 dans les champs de soja [
23 ]. Toutes ces études ont été réalisées sur des sols avec des applications fréquentes de GBH dans la production de maïs et de soja, expliquant l’omniprésence du glyphosate et de l’AMPA. Bien que les taux de détection soient similaires dans toutes les régions du monde, nos résultats suggèrent que les sols de grandes cultures non biologiques du Québec qui ont été échantillonnés dans cette étude contiennent légèrement plus de glyphosate (0,17 µg·g
−1 sol sec ±0,15) et d’AMPA (0,37 µg·g· g
−1 sol sec ±0,24) par rapport aux sols brésiliens (0,08 µg·g
−1 sol sec ±0,09 pour le glyphosate et 0,17 µg·g
−1 sol sec ±0,16 pour l’AMPA) et européens (0,11 µg·g
−1 sol sec sol ±0,13 et 0,13 µg·g
−1 sol sec ±0,14) [
68 ,
69 ] bien que plus petit que le sol argentin (2,30 µg·g
−1 sol sec ±0,48 et 4,20 µg·g
−1 sol sec ±2,26) [
66 ]. Les teneurs en glyphosate et en AMPA mesurées dans l’horizon 0-20 cm en 2019-2020 sont généralement supérieures à celles de l’étude de Maccario menée en 2014 (0,06 µg·g
−1 sol sec ±0,10 et 0,29 µg·g
−1 sol sec ±0,21) [
23 ]. Notre analyse montre que les contenus en AMPA ne sont pas significativement différents entre 2014 et 2020 pour cinq producteurs. En revanche, il existe une différence significative de teneur en glyphosate entre 2014 et 2020 pour les deux producteurs ayant des demandes de GBH supérieures à 5 400 g·ha
−1 entre 2017 et 2020. Ce constat est en accord avec Primost et al. [
66 ] qui ont rapporté que la teneur en glyphosate était mieux corrélée aux applications cumulées de GBH sur plusieurs années par rapport à la dernière dose de pulvérisation. L’accumulation de glyphosate dans le sol semble se produire à un rythme inférieur à celui prévu par Primost et al. [
66 ]. Il a été suggéré qu’une augmentation de la teneur en glyphosate de 1 µg·g
−1 de sol sec se produirait toutes les 5 applications de GBH [
66 ]. Cependant, au cours de plus de 6 années d’applications annuelles de GBH, nous avons observé une augmentation moyenne de 0,20 µg·g
−1 de sol sec pour trois champs (sites G, H, I) et aucune augmentation significative pour un champ (site D). ).
4.2. Impacts des propriétés du sol et des systèmes de culture sur la teneur en glyphosate et en AMPA
Nos résultats démontrent que la gestion biologique entraîne une différence significative dans la teneur en glyphosate et en AMPA dans les sols, ce qui est intuitif puisque l’application de GBH est interdite dans ce type de système de culture (
Figure S2 ). Lorsque l’on exclut les sites biologiques de notre analyse, les applications cumulatives de GBH trois ans avant l’échantillonnage influencent de manière significative la teneur en glyphosate du sol, mais pas la teneur en AMPA (
Figure 4 ). Cette différence entre le comportement du glyphosate et celui de l’AMPA dans les sols pourrait s’expliquer par la pseudo-persistance du glyphosate liée à des apports fréquents de glyphosate supérieurs aux taux de dissipation [
66 ] et par l’utilisation de résidus de culture comme couverture de sol pour le semis direct. chantiers [
70 ]. Même avec un taux de dissipation rapide du glyphosate dans les sols [
5 ,
71 ], des apports relativement élevés de glyphosate (> 1 350 g·ha
-1 ·an
-1 ) dans les sols agricoles pourraient entraîner une accumulation partielle de glyphosate qui ne se dégrade pas dans l’AMPA et lessivage supplémentaire dans les horizons plus profonds du sol, en particulier après de fortes pluies [
72 ]. Pour les sols recouverts de biomasse végétale (c’est-à-dire des plantes vivantes ou des résidus de cultures) au moment de l’application de GBH, une partie du GBH appliqué est interceptée par la biomasse végétale plutôt que sur le sol, ce qui modifie la dissipation du glyphosate [
70 ,
73 ,
74 ,
75 ]. Le glyphosate intercepté par la biomasse végétale ralentira généralement la dissipation du glyphosate par rapport à l’application directement sur le sol, car une plus grande partie du glyphosate est incorporée ou adsorbée sur la biomasse végétale par rapport aux particules du sol [
70 ,
74 ]. La biomasse végétale doit être dégradée pour que le glyphosate adsorbé et incorporé se dissipe dans le sol [
70 ,
73 ]. La biomasse végétale déjà partiellement dégradée adsorbera le glyphosate plus fortement que la biomasse végétale fraîche [
73 ] et une plus grande partie du glyphosate restera sous forme de résidus non extractibles trouvés dans la biomasse végétale [
75 ]. Le recours au travail du sol pour incorporer les résidus de culture accélérera la dégradation de la biomasse végétale en la mélangeant au sol [
70 ]. Par conséquent, les sites avec des pratiques sans labour et une utilisation fréquente de cultures de couverture (sites G, H et I) pourraient entraîner une dissipation plus lente du glyphosate par rapport aux sites avec un travail du sol et une couverture du sol plus faible par les résidus de culture (site D). De plus, des applications répétées de GBH peuvent entraîner une diminution de l’activité microbienne du sol et de la respiration du sol [
76 ,
77 ], inhibant potentiellement la biodégradation du glyphosate en AMPA [
40]. Par conséquent, des applications plus élevées de GBH ne pourraient pas conduire directement à des teneurs plus élevées en AMPA dans le sol, mais plutôt à une accumulation de glyphosate. De telles interprétations pourraient expliquer la teneur plus élevée en glyphosate dans les profils de sol plus profonds pour les sites avec > 5 400 g·ha
−1 de GBH appliqués entre 2017 et 2020 (
Tableau 3 ) et l’augmentation avec le temps du glyphosate dans les mêmes sites échantillonnés en 2014 et en 2020. (
Figure 3 ).Le pH du sol, l’ISP et la teneur en argile ont un effet significatif sur la teneur en glyphosate et en AMPA du sol, similaire aux expériences précédentes [
7 ,
8 ]. Nos observations d’une relation négative générale entre le glyphosate et le pH du sol et d’une relation positive entre le glyphosate et la teneur en argile sont en accord avec la littérature [
78 ,
79 ,
80 ,
81 ]. Une étude réalisée en Argentine a montré que le glyphosate présente une affinité plus élevée pour les surfaces du sol à un certain pH, qui varie selon les types de sol mais se situe généralement autour du pH 6 [
82 ], ce qui correspond aux valeurs de pH du sol plus faibles enregistrées dans nos expériences. Dans la même étude, il a été démontré que la présence de phosphate réduit l’adsorption du glyphosate sur les particules du sol [
82 ], ce qui concorde avec notre découverte d’une relation négative entre la teneur en glyphosate et la valeur ISP du sol (
Figure 4 ). La teneur en argile et l’ISP ne présentent pas de corrélation significative avec les teneurs en AMPA, tandis que la CEC du sol a une relation positive avec les teneurs en AMPA. Maccario et coll. [
23 ] a également constaté que la texture du sol n’avait pas d’impact sur la teneur en AMPA. Cela pourrait s’expliquer par la plus grande affinité du sol pour l’AMPA par rapport au glyphosate [
14 ,
83 ].
4.3. Impacts des systèmes de culture et des propriétés du sol sur la communauté microbienne du sol
La diversité alpha et la biomasse totale des communautés procaryotes et fongiques ne sont pas affectées par les rotations des cultures dans notre étude. Seule la diversité alpha eucaryote est significativement impactée par les applications cumulatives du GBH. Les applications cumulatives élevées de GBH dans cette étude sont liées à d’autres choix de gestion tels que la culture sans labour. Par conséquent, la relation positive entre l’application du GBH et les communautés eucaryotes pourrait s’expliquer par l’adoption du semis direct ainsi que par une application élevée du GBH. En effet, Kepler et al. [
33 ] ont montré que l’impact des applications de GBH sur les communautés microbiennes du sol était négligeable par rapport aux pratiques de travail du sol. Bien qu’une méta-analyse n’ait montré aucun impact significatif sur la diversité fongique des pratiques sans labour [
84 ], d’autres études ont montré l’effet négatif du travail du sol sur la communauté eucaryote du sol [
85 ,
86 ,
87 ,
88 ], ce qui conforte notre hypothèse.La composition de la communauté microbienne du sol et son potentiel fonctionnel sont influencés à la fois par les propriétés du sol et les systèmes de culture dans notre étude. La teneur en sodium a l’effet le plus important sur la composition des communautés microbiennes, ce qui est difficile à expliquer. Le sodium du sol peut avoir des effets négatifs importants à des teneurs élevées (1 000 ppm) [
89 ,
90 ] ; cependant, dans cette étude, tous les échantillons de sol présentent des teneurs en Na inférieures à 40 ppm avec des valeurs aussi basses que 2,7 ppm. Aucun effet important du Na sur les communautés microbiennes du sol n’a été signalé aux concentrations observées dans notre étude. La texture du sol a un effet important sur la composition des communautés microbiennes et leur potentiel fonctionnel. De nombreuses études ont confirmé l’effet déterminant de la texture du sol sur la composition et le potentiel fonctionnel des communautés microbiennes [
91 ,
92 ,
93 ]. En termes de systèmes de culture, la rotation des cultures et la fréquence d’application du fumier sont souvent citées comme ayant un effet significatif sur les communautés microbiennes du sol [
94 ,
95 ,
96 ]. Guo et coll. [
95 ] ont montré que l’application d’engrais, en particulier de fumier, avait un rôle plus important que la rotation des cultures et le stade de croissance des cultures sur les communautés microbiennes du sol. Une autre étude a montré que toutes les communautés microbiennes ne sont pas affectées de la même manière par la rotation des cultures, les communautés fongiques étant plus sensibles au nombre d’espèces végétales dans une rotation des cultures par rapport aux communautés procaryotes [
97 ]. Dans la présente étude, aucun effet significatif de l’application de GBH sur la structure de la communauté microbienne du sol et son potentiel fonctionnel n’a été observé, ce qui est cohérent avec d’autres rapports de la littérature utilisant des approches ADN pour évaluer les communautés microbiennes [
33 ,
77 ,
98 ,
99 ]. Cela suggère que d’autres pratiques de gestion, telles que la rotation des cultures, les apports de fumier et le travail du sol, ont un impact plus important sur la composition de la communauté microbienne du sol et sur son potentiel fonctionnel que les applications GBH.
5. Conclusions
Le glyphosate et l’AMPA ont été détectés dans les sols de tous les sites étudiés, y compris les sites biologiques. Les doses cumulées de GBH ne sont pas corrélées au contenu du sol AMPA dans les sites conventionnels. Cependant, la teneur en glyphosate du sol était positivement corrélée aux doses cumulées de GBH, et il semble y avoir eu une augmentation de la teneur en glyphosate du sol entre 2014 et 2020 pour les sites ayant les applications de GBH les plus importantes. Un faible pH du sol et une teneur élevée en argile correspondaient à une pseudo-persistance plus élevée du glyphosate et de l’AMPA dans le sol. Les quantités cumulatives d’applications de GBH ne semblent pas avoir d’impact sur les communautés microbiennes du sol, tandis que la rotation des cultures et les apports de fumier ont un impact significatif. Par conséquent, les applications de GBH semblent avoir un impact minimal sur les communautés microbiennes du sol et sur le contenu du sol AMPA. D’un autre côté, les applications de GBH semblent augmenter la teneur en glyphosate du sol et doivent être surveillées pour garantir que l’accumulation de glyphosate n’entraîne pas d’effets néfastes sur les communautés microbiennes du sol.
Matériel supplémentaire
Les informations complémentaires suivantes peuvent être téléchargées sur :
https://www.mdpi.com/article/10.3390/agronomy14040686/s1 , Figure S1 : Corrélation entre la différence de teneur en glyphosate (en haut) et en AMPA (en bas) entre 2019 et 2020 et la différence dans l’application de GBH en 2020 et l’application annuelle moyenne de GBH entre 2017 et 2019. Figure S2 : valeurs des coefficients ainsi que leur intervalle de confiance à 95 % pour toutes les variables indépendantes dans des régressions multiples pour la teneur en AMPA (à droite) et en glyphosate (à gauche) pour 0– Profil de sol de 20 cm de tous les sites. Figure S3 : Chromatographes d’une courbe d’étalonnage en six points pour l’AMPA (A) et d’une courbe d’étalonnage en cinq points pour le glyphosate (B) sur une matrice de sol. Tableau supplémentaire S1 : Effet marginal des propriétés du sol sur la composition des communautés microbiennes pour l’horizon 0–20 du sol.
Contributions d’auteur
Conceptualisation, RH, JD-P., TJ, MM et ML ; méthodologie, WO, RH, JD-P., TJ, MM et ML ; validation, WO, JD-P. et MM ; analyse formelle, WO ; enquête, adjudant, CP et JD-P.; conservation des données, WO et CP ; rédaction – préparation de l’ébauche originale, WO ; rédaction – révision et édition, WO, RH, JD-P., TJ, MM et ML ; visualisation, WO ; supervision, RH et ML ; administration de projet, RH ; acquisition de financement, RH et ML Tous les auteurs ont lu et accepté la version publiée du manuscrit.
Financement
Le financement de cette recherche provenait du programme Innov’Action Agroalimentaire, dans le cadre du Partenariat canadien pour l’agriculture, une entente entre les gouvernements du Canada et du Québec.
Déclaration de disponibilité des données
Des ensembles de données accessibles au public ont été analysés dans cette étude. Ces données et scripts de figures peuvent être trouvés ici :
https://github.com/woverbeek/AgronomyMDPI2024 , consulté le 27 février 2024.
Remerciements
Les auteurs souhaitent remercier tous les agriculteurs qui nous ont permis d’échantillonner leurs champs et ont donné de leur temps pour répondre à nos questions.
Les conflits d’intérêts
Les auteurs ne déclarent aucun conflit d’intérêts.
Les références
- Novotny, E. Glyphosate, Roundup et les échecs de l’évaluation réglementaire. Toxiques 2022 , 10 , 321. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Szekacs, A. ; Darvas, B. Quarante ans avec le glyphosate. Herbique.-Prop. Synthé. Contrôler les mauvaises herbes 2012 , 14 , 247-284. [ Google Scholar ]
- Ministère de l’Environnement, de la Lutte Contre les Changements Climatiques. Bilan des Ventes de Pesticides au Québec—Année 2021 ; Bibliothèque et Archives Nationales du Québec : Montréal, QC, Canada, 2023. [ Google Scholar ]
- Kanissery, R. ; Gairhe, B. ; Kadyampakeni, D. ; Batuman, O. ; Alferez, F. Glyphosate : Sa persistance dans l’environnement et son impact sur la santé et la nutrition des cultures. Plantes 2019 , 8 , 499. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Carretta, L. ; Cardinali, A. ; Onofri, A. ; Masin, R. ; Zanin, G. Dynamique du glyphosate et de l’acide aminométhylphosphonique dans le sol sous labour conventionnel et de conservation. Int. J. Environ. Rés. 2021 , 15 , 1037-1055. [ Google Scholar ] [ CrossRef ]
- Motharasan, M. ; Yunus ; Shukor, Y. ; Yasid, N. ; Wan Johari, WL ; Johari, W. ; Aqlima, S. Devenir environnemental et dégradation du glyphosate dans le sol. Pertanika J. Sch. Rés. Rév.2018 , 4 , 102-116 . [ Google Scholar ]
- Dollinger, J. ; Dagès, C. ; Voltz, M. Adsorption du glyphosate dans les sols et les sédiments prédite par les fonctions de pédotransfert. Environ. Chimique. Lett. 2015 , 13 , 293-307. [ Google Scholar ] [ CrossRef ]
- De Gerónimo, E. ; Aparicio, VC; Costa, JL Adsorption du glyphosate dans les sols d’Argentine. Estimation du coefficient d’affinité par fonction de pédotransfert. Géoderme 2018 , 322 , 140-148. [ Google Scholar ] [ CrossRef ]
- Ascolani Yael, J. ; Fuhr, JD; Bocan, Géorgie ; Daza Millone, A. ; Tognalli, N. ; dos Santos Afonso, M. ; Martiarena, ML Dégradation abiotique du glyphosate en acide aminométhylphosphonique en présence de métaux. J. Agric. Chimie alimentaire. 2014 , 62 , 9651-9656. [ Google Scholar ] [ CrossRef ]
- Papagiannaki, D. ; Médana, C. ; Binetti, R. ; Calza, P. ; Roslev, P. Effet de l’irradiation UV-A, UV-B et UV-C du glyphosate sur la photolyse et l’atténuation de la toxicité aquatique. Sci. Rep. 2020 , 10 , 20247. [ Google Scholar ] [ CrossRef ]
- Singh, S. ; Kumar, V. ; Gill, JPK; Datta, S. ; Singh, S. ; Dacca, V. ; Kapoor, D. ; Wani, Alberta; Dhanjal, DS; Kumar, M. ; et coll. Herbicide Glyphosate : toxicité et dégradation microbienne. Int. J. Environ. Rés. Santé publique 2020 , 17 , 7519. [ Google Scholar ] [ CrossRef ]
- Carretta, L. ; Masin, R. ; Zanin, G. Revue des études analysant la présence de glyphosate et d’acide aminométhylphosphonique (AMPA) dans les eaux souterraines. Environ. Rév.2021 , 30 , 88-109 . [ Google Scholar ] [ CrossRef ]
- Tang, FHM ; Jeffries, TC ; Vervoort, RW; Conoley, C. ; Coleman, Nevada ; Maggi, F. Expériences de microcosme et modélisation cinétique de la biodégradation du glyphosate dans les sols et les sédiments. Sci. Environ. Total. 2019 , 658 , 105-115. [ Google Scholar ] [ CrossRef ]
- Wimmer, B. ; Langarica-Fuentes, A. ; Schwarz, E. ; Kleindienst, S. ; Huhn, C. ; Pagel, H. La modélisation mécanistique indique une dissipation rapide du glyphosate et une persistance induite par la sorption de son métabolite AMPA dans le sol. J. Environ. Qual. 2023 , 52 , 393-405. [ Google Scholar ] [ CrossRef ]
- Blake, R. ; Pallett, K. Le devenir environnemental et l’écotoxicité du glyphosate. Gestion antiparasitaire Outlook. 2018 , 29 , 266-269. [ Google Scholar ] [ CrossRef ]
- von Mérey, G. ; Manson, PS ; Mehrsheikh, A. ; Sutton, P. ; Levine, SL Évaluation des risques chroniques pour le glyphosate et l’acide aminométhylphosphonique pour le biote du sol. Environ. Toxicol. Chimique. 2016 , 35 , 2742-2752. [ Google Scholar ] [ CrossRef ]
- Kim, YJ ; Nitin, N. ; Kim, KB Différences toxicocinétiques négligeables du glyphosate par différents véhicules chez le rat. Toxiques 2023 , 11 , 67. [ Google Scholar ] [ CrossRef ]
- Kassam, A. ; Friedrich, T. ; Derpsch, R. Propagation mondiale de l’agriculture de conservation. Int. J. Environ. Goujon. 2019 , 76 , 29-51. [ Google Scholar ] [ CrossRef ]
- FAO. Top 5 des choses à savoir sur l’agriculture de conservation. Disponible en ligne : http://www.fao.org/zhc/detail-events/en/c/238478/ (consulté le 27 février 2024).
- Bilodeau, L.; Marcoux, A. ; Miville, D. ; Fréchette, I. ; Samson, V. Désherbage du Maïs de Grandes Cultures. 2020. Disponible en ligne : https://www.agrireseau.net/documents/Document_100450.pdf (consulté le 20 février 2024).
- Kumar, V. ; Mahajan, G. ; Dahiya, S. ; Chauhan, BS Défis et opportunités pour la gestion des mauvaises herbes dans les systèmes agricoles sans labour. Dans Systèmes de culture sans labour pour une agriculture durable : défis et opportunités ; Dang, YP, Dalal, RC, Menzies, NW, éd. ; Springer International Publishing : Cham, Suisse, 2020 ; pp. 107-125. [ Google Scholar ]
- Giroux, I. Présence de Pesticides dans l’Eau au Québec : Portrait et Tendances dans les Zones de Maïs et de Soya—2018 à 2020 ; Ministère de l’Environnement et de la Lutte Contre les Changements Climatiques, Direction de la Qualité des Milieux Aquatiques : Québec, QC, Canada, 2022. [ Google Scholar ]
- Maccario, S. ; Lucotte, M. ; Moingt, M. ; Samson-Brais, É.; Smedbol, É. ; Labrecque, M. Impact des caractéristiques des sols et des pratiques de gestion des mauvaises herbes sur la persistance du glyphosate et de l’AMPA dans les sols de grandes cultures des basses terres du Saint-Laurent (Québec, Canada). Agronomie 2022 , 12 , 992. [ Google Scholar ] [ CrossRef ]
- Nkongolo, KK; Narendrula-Kotha, R. Progrès dans la surveillance de la dynamique et de la fonction de la communauté microbienne du sol. J.Appl. Genet. 2020 , 61 , 249-263. [ Google Scholar ] [ CrossRef ]
- Parada, AE ; Needham, DM; Fuhrman, JA Chaque base compte : évaluation des amorces d’ARNr de petites sous-unités pour les microbiomes marins avec des communautés simulées, des séries chronologiques et des échantillons mondiaux de terrain. Environ. Microbiol. 2016 , 18 , 1403-1414. [ Google Scholar ] [ CrossRef ]
- Bokulich, NA; Mills, DA Une sélection améliorée d’amorces transcrites spécifiques aux espaceurs internes permet un profilage quantitatif à ultra-haut débit des communautés fongiques. Appl. Environ. Microbiol. 2013 , 79 , 2519-2526. [ Google Scholar ] [ CrossRef ]
- Comeau, AM; Li, WKW; Tremblay, J.-É.; Carmack, CE; Lovejoy, C. Structure de la communauté microbienne de l’océan Arctique avant et après le minimum record de glace de mer de 2007. PLoS ONE 2011 , 6 , e27492. [ Google Scholar ] [ CrossRef ]
- Emerson, JB ; Thomas, Colombie-Britannique ; Alvarez, W. ; Banfield, JF Analyse métagénomique d’une communauté microbienne souterraine à haute teneur en dioxyde de carbone peuplée de chimiolithoautotrophes, de bactéries et d’archées provenant de phylums candidats. Environ. Microbiol. 2016 , 18 , 1686-1703. [ Google Scholar ] [ CrossRef ]
- Castellano-Hinojosa, A. ; González-López, J. ; Vallejo, A. ; Bedmar, EJ Effet des inhibiteurs d’uréase et de nitrification sur la volatilisation de l’ammoniac et l’abondance des gènes du cycle N dans un sol agricole. J. Plante Nutr. Science du sol. 2020 , 183 , 99-109. [ Google Scholar ] [ CrossRef ]
- Morales, MOI ; Allegrini, M. ; Basualdo, J. ; Villamil, Manitoba ; Zabaloy, conception MC Primer pour évaluer la dégradation bactérienne du glyphosate et d’autres phosphonates. J. Microbiol. Méthodes 2020 , 169 , 105814. [ Google Scholar ] [ CrossRef ]
- Kanehisa, M. ; Furumichi, M. ; Sato, Y. ; Kawashima, M. ; Ishiguro-Watanabe, M. KEGG pour l’analyse taxonomique des voies et des génomes. Acides nucléiques Res. 2023 , 51 , D587-D592. [ Google Scholar ] [ CrossRef ]
- Nilsson, RH; Kristiansson, E. ; Ryberg, M. ; Hallenberg, N. ; Larsson, KH Variabilité intraspécifique des ITS dans le règne des champignons telle qu’exprimée dans les bases de données de séquences internationales et ses implications pour l’identification des espèces moléculaires. Évol. Bioinformer. En ligne 2008 , 4 , 193-201. [ Google Scholar ] [ CrossRef ]
- Kepler, RM; Epp Schmidt, DJ ; Yarwood, SA ; Cavigelli, MA; Reddy, KN ; Duc, DONC ; Bradley, Californie ; Williams, MM; Acheteur, JS ; Maul, JE Communautés microbiennes du sol dans divers agroécosystèmes exposés à l’herbicide glyphosate. Appl. Environ. Microbiol. 2020 , 86 , e01744-19. [ Google Scholar ] [ CrossRef ]
- Dennis, PG ; Kukulies, T. ; Forstner, C. ; Orton, TG; Pattison, AB Les effets du glyphosate, du glufosinate, du paraquat et du paraquat-diquat sur l’activité microbienne du sol et sur la diversité bactérienne, archéenne et nématode. Sci. Rep. 2018 , 8 , 2119. [ Google Scholar ] [ CrossRef ]
- Tisserand, MA ; Krutz, LJ; Zablotowicz, RM; Reddy, KN Effets du glyphosate sur les communautés microbiennes du sol et sa minéralisation dans un sol du Mississippi. Gestion antiparasitaire. Sci. 2007 , 63 , 388-393. [ Google Scholar ] [ CrossRef ]
- Guijarro, KH; Aparicio, V. ; De Gerónimo, E. ; Castellote, M. ; Figuerola, EL; Costa, JL; Erijman, L. Communautés microbiennes du sol et dégradation du glyphosate dans des sols ayant des antécédents d’application d’herbicides différents. Sci. Environ. Total. 2018 , 634 , 974-982. [ Google Scholar ] [ CrossRef ]
- Lupwayi, Nouvelle-Zélande ; Larney, FJ; Blackshaw, RE; Kanashiro, DA; Pearson, DC ; Petri, RM Le pyroséquençage révèle les profils des communautés bactériennes du sol après 12 ans de gestion de conservation sur les rotations de cultures irriguées. Appl. Ecol du sol. 2017 , 121 , 65-73. [ Google Scholar ] [ CrossRef ]
- Schmidt, R. ; Graver, K. ; Bossange, AV; Mitchell, J. ; Scow, K. Utilisation à long terme de cultures de couverture et stratégies de vie de la communauté microbienne du sol sans labour dans les sols agricoles. PLoS ONE 2018 , 13 , e0192953. [ Google Scholar ] [ CrossRef ]
- Giusti, B. ; Hogue, R. ; Jeanne, T. ; Lucotte, M. Impacts du blé d’hiver et des cultures de couverture sur la diversité microbienne du sol dans un système de culture sans labour maïs-soja au Québec (Canada). Agrosyste. Géosci. Environ. 2023 , 6 , e20349. [ Google Scholar ] [ CrossRef ]
- Samson-Brais, É.; Lucotte, M. ; Moingt, M. ; Tremblay, G. ; Paquet, S. Teneurs en glyphosate et en acide aminométhylphosphonique dans les sols de grandes cultures selon diverses pratiques de lutte contre les mauvaises herbes. Agrosyste. Géosci. Environ. 2022 , 5 , e20273. [ Google Scholar ] [ CrossRef ]
- Alferness, PL; Iwata, Y. Détermination du glyphosate et de l’acide (aminométhyl)phosphonique dans les matrices de sol, végétales et animales et dans l’eau par chromatographie en phase gazeuse capillaire avec détection sélective de masse. J. Agric. Chimie alimentaire. 1994 , 42 , 2751-2759. [ Google Scholar ] [ CrossRef ]
- Conseil des Productions Végétales du Québec. Méthode MA-2 ; Ministère de l’Agriculture, des Pêcheries et de l’Alimentation (Québec) : Québec, QC, Canada, 1993. [ Google Scholar ]
- Centre d’Expertise en Analyse Environnementale du Québec. Détermination du pH : Méthode Électrométrique ; Ministère de l’Environnement, de la Lutte contre les changements climatiques, de la Faune et des Parcs : Québec, QC, Canada, 2014; Tome 3. [ Google Scholar ]
- Cordonnier, HE; McLean, EO; Pratt, PF Méthodes tampons pour déterminer les besoins en chaux des sols contenant des quantités appréciables d’aluminium extractible. Science du sol. Soc. Suis. J. 1961 , 25 , 274-277. [ Google Scholar ] [ CrossRef ]
- Mehlich, A. Extracteur d’analyse de sol Mehlich 3 : Une modification de l’extracteur Mehlich 2. Commun. Science du sol. Plante Anale. 1984 , 15 , 1409-1416. [ Google Scholar ] [ CrossRef ]
- Culman, S. ; Mann, M. ; Brown, C. Calcul de la capacité d’échange de cations, de la saturation en base et de la saturation en calcium. 2019. Disponible en ligne : https://ohioline.osu.edu/factsheet/anr-81 (consulté le 19 février 2024).
- CRAAQ. Guide de référence sur la fertilisation , 2e éd.; CRAAQ : Québec, QC, Canada, 2010. (En français) [ Google Scholar ]
- Apprill, A. ; McNally, S. ; Parsons, R. ; Weber, L. Une révision mineure de l’amorce du gène SSU rRNA 806R de la région V4 augmente considérablement la détection du bactérioplancton SAR11. Aquat. Microbe. Écol. 2015 , 75 , 129-137. [ Google Scholar ] [ CrossRef ]
- Jeanne, T. ; Parent, S.-É.; Hogue, R. Utilisation d’un indice d’équilibre des espèces bactériennes du sol pour estimer la productivité des cultures de pommes de terre. PLoS ONE 2019 , 14 , e0214089. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Bolyen, E. ; Rideout, JR ; Dillon, M. ; Bokulich, NA; Abnet, CC; Al-Ghalith, Géorgie ; Alexandre, H. ; Alm, EJ; Arumugam, M. ; Asnicar, F. ; et coll. Science des données du microbiome reproductible, interactive, évolutive et extensible à l’aide de QIIME 2. Nat. Biotechnologie. 2019 , 37 , 852-857. [ Google Scholar ] [ CrossRef ]
- Callahan, BJ; McMurdie, PJ ; Rosen, MJ; Han, AW; Johnson, AJA; Holmes, SP DADA2 : Inférence d’échantillons haute résolution à partir des données d’amplicons Illumina. Nat. Méthodes 2016 , 13 , 581-583. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Quast, C. ; Pruesse, E. ; Yilmaz, P. ; Gerken, J. ; Schweer, T. ; Yarza, P. ; Péplies, J. ; Glöckner, FO Le projet de base de données de gènes d’ARN ribosomal SILVA : traitement des données amélioré et outils Web. Acides nucléiques Res. 2013 , 41 , D590-D596. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Kõljalg, U. ; Nilsson, RH; Abarenkov, K. ; Tedersoo, L. ; Taylor, AFS; Bahram, M. ; Bates, ST ; Bruns, TD; Bengtsson-Palme, J. ; Callaghan, TM; et coll. Vers un paradigme unifié pour l’identification des champignons basée sur des séquences. Mol. Écol. 2013 , 22 , 5271-5277. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Callahan, BJ; McMurdie, PJ ; Holmes, SP Les variantes de séquence exactes devraient remplacer les unités taxonomiques opérationnelles dans l’analyse des données sur les gènes marqueurs. ISME J. 2017 , 11 , 2639-2643. [ Google Scholar ] [ CrossRef ]
- Overbeek, W. ; Jeanne, T. ; Hogue, R. ; Smith, DL Effets des consortiums microbiens, appliqués comme revêtement d’engrais, sur les communautés microbiennes du sol et de la rhizosphère et sur le rendement des pommes de terre. Devant. Agron. 2021 , 3 , 714700. [ Google Scholar ] [ CrossRef ]
- Jeanne, T. ; D’Astous-Pagé, J.; Hogue, R. Variabilité spatiale, temporelle et technique de la diversité des procaryotes et des champignons dans les sols agricoles. Devant. Science du sol. 2022 , 2 , 945888. [ Google Scholar ] [ CrossRef ]
- Douglas, directeur général ; Maffei, VJ; Zaneveld, JR; Yurgel, SN; Brun, JR ; Taylor, CM ; Huttenhower, C. ; Langille, MGI PICRUSt2 pour la prédiction des fonctions du métagénome. Nat. Biotechnologie. 2020 , 38 , 685-688. [ Google Scholar ] [ CrossRef ]
- Caspi, R. ; Billington, R. ; Ferrer, L. ; Foerster, H. ; Fulcher, Californie ; Keseler, IM; Kothari, A. ; Krummenacker, M. ; Latendresse, M. ; Mueller, LA ; et coll. La base de données MetaCyc des voies métaboliques et des enzymes et la collection BioCyc de bases de données de voies/génomes. Acides nucléiques Res. 2016 , 44 , D471-D480. [ Google Scholar ] [ CrossRef ]
- Hernández Guijarro, K. ; De Gerónimo, E. ; Erijman, L. Potentiel de biodégradation du glyphosate dans le sol basé sur le gène de la glycine oxydase (thiO) de Bradyrhizobium. Curr. Microbiol. 2021 , 78 , 1991-2000. [ Google Scholar ] [ CrossRef ]
- Hove-Jensen, B. ; Zechel, DL; Jochimsen, B. Utilisation du glyphosate comme phosphate Source : Biochimie et génétique de la lyase carbone-phosphore bactérienne. Microbiol. Mol. Biol. Rév.2014 , 78 , 176-197 . [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Équipe de base R. R : Un langage et un environnement pour le calcul statistique ; R Foundation for Statistical Computing : Vienne, Autriche, 2020. [ Google Scholar ]
- McMurdie, PJ ; Holmes, S. Ne gaspillez pas, ne voulez pas : pourquoi la raréfaction des données sur le microbiome est inacceptable. Calcul PLoS. Biol. 2014 , 10 , e1003531. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- McMurdie, PJ ; Holmes, S. phyloseq : Un package R pour une analyse interactive reproductible et des graphiques des données de recensement du microbiome. PLoS ONE 2013 , 8 , e61217. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Oksanen, J. ; Blanchet, G. ; Amicalement, M. ; Kindt, R. ; Legendre, P. ; McGlinn, D. ; Minchin, P. ; O’Hara, R. ; Simpson, G. ; Solymos, P. ; et coll. Végétalien : Forfait Écologie Communautaire. 2019. Disponible en ligne : http://CRAN.Rproject.org/package=vegan (consulté le 14 février 2024).
- Daughton Christian, G. Gestion du berceau au berceau des médicaments pour minimiser leur élimination dans l’environnement tout en favorisant la santé humaine. I. Justification et pistes vers une pharmacie verte. Environ. Perspective de santé. 2003 , 111 , 757-774. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Primost, J. ; Marin, D. ; Aparicio, V. ; Costa, J. ; Carriquiriborde, P. Glyphosate et AMPA, polluants « pseudo-persistants » dans le cadre de pratiques de gestion agricole réelles dans l’agroécosystème mésopotamique de la Pampa, Argentine. Environ. Polluer. 2017 , 229 , 771-779. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Fuchs, B. ; Saikkonen, K. ; Hélander, M. ; Tian, Y. ; Yang, B. ; Engström, MT ; Salminen, J.-P. ; Muola, A. Héritage des produits agrochimiques dans l’économie alimentaire circulaire : les herbicides à base de glyphosate introduits via le fumier affectent le rendement et la biochimie des plantes cultivées vivaces au cours de l’année suivante. Chemosphere 2022 , 308 , 136366. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Giard, F. ; Lucotte, M. ; Moingt, M. ; Gaspar, A. Teneur en glyphosate et en aminométhyphosphonique (AMPA) dans les sols des grandes cultures brésiliennes. Agron. Sci. Biotechnologie. 2022 , 8 , 1–18. [ Google Scholar ] [ CrossRef ]
- Silva, V. ; Montanarella, L. ; Jones, A. ; Fernández-Ugalde, O. ; Mol, HGJ; Ritsema, CJ; Geissen, V. Distribution du glyphosate et de l’acide aminométhylphosphonique (AMPA) dans les couches arables agricoles de l’Union européenne. Sci. Environ. Total. 2018 , 621 , 1352-1359. [ Google Scholar ] [ CrossRef ]
- Mamy, L. ; Barriuso, E. ; Gabrielle, B. Devenir du glyphosate dans les sols lorsqu’il arrive dans les résidus végétaux. Chemosphère 2016 , 154 , 425-433. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Mencaroni, M. ; Cardinali, A. ; Costa, L. ; Morari, F. ; Salandin, P. ; Zanin, G. ; Dal Ferro, N. Glyphosate et AMPA ont une faible mobilité à travers différents profils de sol de la zone de production de vin prosecco : une étude de surveillance dans le nord-est de l’Italie. Devant. Environ. Sci. 2022 , 10 , 971931. [ Google Scholar ] [ CrossRef ]
- Vereecken, H. Mobilité et lixiviation du glyphosate : une revue. Gestion antiparasitaire. Sci. 2005 , 61 , 1139-1151. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Cassigneul, A. ; Benoit, P. ; Bergheaud, V. ; Dumény, V. ; Etiévant, V. ; Goubard, Y. ; Maylin, A. ; Justes, E. ; Alletto, L. Devenir du glyphosate et de ses produits de dégradation dans les résidus de cultures de couverture et le sol sous-jacent : une étude en laboratoire. Sci. Environ. Total. 2016 , 545-546 , 582-590. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Aslam, S. ; Iqbal, A. ; Lafolie, F. ; Recous, S. ; Benoit, P. ; Garnier, P. Le paillis de résidus végétaux à la surface du sol impacte le lessivage et la persistance des pesticides : Une étude de modélisation à partir de colonnes de sol. J. Contam. Hydrol. 2018 , 214 , 54-64. [ Google Scholar ] [ CrossRef ]
- Aslam, S. ; Jing, Y. ; Nowak, KM Devenir du glyphosate et de ses produits de dégradation AMPA, glycine et sarcosine dans un sol agricole : implications pour l’évaluation des risques environnementaux. J. Hazard. Maître. 2023 , 447 , 130847. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Samson-Brais, É.; Lucotte, M. ; Moingt, M. ; Tremblay, G. ; Paquet, S. Impact des pratiques de gestion des mauvaises herbes sur l’activité biologique des sols de grandes cultures de maïs et de soja au Québec (Canada). Peut. J. Sol Sci. 2020 , 101 , 12-21. [ Google Scholar ] [ CrossRef ]
- Voie, M. ; Lorenz, N. ; Saxena, J. ; Ramsier, C. ; Dick, R. L’effet du glyphosate sur l’activité microbienne du sol, la structure de la communauté microbienne et le potassium du sol. Pédobiologie 2012 , 55 , 335-342. [ Google Scholar ] [ CrossRef ]
- McConnell, JS; Hossner, LR Isothermes d’adsorption dépendant du pH du glyphosate. J. Agric. Chimie alimentaire. 1985 , 33 , 1075-1078. [ Google Scholar ] [ CrossRef ]
- de Jonge, H. ; Wollesen de Jonge, L. Influence du pH et de la composition de la solution sur la sorption du glyphosate et du prochloraz dans un sol limoneux sableux. Chemosphère 1999 , 39 , 753-763. [ Google Scholar ] [ CrossRef ]
- Weber, JB ; Wilkerson, GG; Reinhardt, CF Calcul des coefficients de sorption des pesticides (Kd) à l’aide de propriétés de sol sélectionnées. Chemosphère 2004 , 55 , 157-166. [ Google Scholar ] [ CrossRef ]
- Kumari, KGID ; Moldrup, P. ; Paradelo, M. ; Elsgaard, L. ; de Jonge, LW Les propriétés du sol contrôlent la sorption du glyphosate dans les sols modifiés avec du biochar de bois de bouleau. Pollution de l’eau, de l’air et du sol. 2016 , 227 , 174. [ Google Scholar ] [ CrossRef ]
- De Gerónimo, E. ; Aparicio, VC Les changements dans le pH du sol et l’ajout de phosphate inorganique affectent l’adsorption du glyphosate dans le sol agricole. EUR. J. Sol Sci. 2022 , 73 , e13188. [ Google Scholar ] [ CrossRef ]
- Sidoli, P. ; Baran, N. ; Angulo-Jaramillo, R. Adsorption du glyphosate et de l’AMPA dans les sols : expériences de laboratoire et règles de pédotransfert. Environ. Sci. Polluer. Rés. 2016 , 23 , 5733-5742. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Li, Y. ; Chanson, D. ; Liang, S. ; Dan, P. ; Qin, X. ; Liao, Y. ; Siddique, KHM Effet du non-labour sur la diversité des communautés bactériennes et fongiques du sol : une méta-analyse. Travail du sol Res. 2020 , 204 , 104721. [ Google Scholar ] [ CrossRef ]
- Soleil, R. ; Li, W. ; Dong, W. ; Tian, Y. ; Hu, C. ; Liu, B. Le travail du sol modifie la répartition verticale des communautés bactériennes et fongiques du sol. Devant. Microbiol. 2018 , 9 , 699. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Gao, M. ; Li, H. ; Li, M. Effet du système sans labour sur la structure de la communauté fongique du sol des terres cultivées à Mollisol : une étude de cas. Devant. Microbiol. 2022 , 13 , 847691. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Lu, X. ; Lu, X. ; Liao, Y. Effet du traitement du sol sur la diversité de la teneur en carbone des champignons mycorhiziens arbusculaires du sol et des agrégats du sol. Devant. Microbiol. 2018 , 9 , 410634. [ Google Scholar ] [ CrossRef ]
- Liu, W. ; Maman, K. ; Wang, X. ; Wang, Z. ; Negrete-Yankelevich, S. Effets du sans labour et des engrais organiques d’origine biologique sur les communautés fongiques mycorhiziennes arbusculaires du sol dans les champs de blé d’hiver. Appl. Ecol du sol. 2022 , 178 , 104564. [ Google Scholar ] [ CrossRef ]
- Zhang, W.-w.; Wang, C. ; Xue, R. ; Wang, L.-j. Effets de la salinité sur la communauté microbienne du sol et la fertilité du sol. J. Intégré. Agricole. 2019 , 18 , 1360-1368. [ Google Scholar ] [ CrossRef ]
- Rath, KM; Rousk, J. Effets du sel sur la communauté des décomposeurs microbiens du sol et leur rôle dans le cycle du carbone organique : une revue. Biol du sol. Biochimie. 2015 , 81 , 108-123. [ Google Scholar ] [ CrossRef ]
- Obayomi, O. ; Seyoum, MM; Ghazaryan, L. ; Tebbé, CC ; Murase, J. ; Bernstein, N. ; Gillor, O. La texture et les propriétés du sol plutôt que le type d’eau d’irrigation façonnent la diversité et la composition des communautés microbiennes du sol. Appl. Ecol du sol. 2021 , 161 , 103834. [ Google Scholar ] [ CrossRef ]
- Xia, Q. ; Rufty, T. ; Shi, W. Diversité et composition microbiennes du sol : liens avec la texture du sol et les propriétés associées. Biol du sol. Biochimie. 2020 , 149 , 107953. [ Google Scholar ] [ CrossRef ]
- Mann, C. ; Lynch, D. ; Fillmore, S. ; Mills, A. Relations entre la gestion des champs, la santé des sols et la composition de la communauté microbienne. Appl. Ecol du sol. 2019 , 144 , 12-21. [ Google Scholar ] [ CrossRef ]
- Venter, ZS ; Jacobs, K. ; Hawkins, H.-J. L’impact de la rotation des cultures sur la diversité microbienne du sol : une méta-analyse. Pédobiologie 2016 , 59 , 215-223. [ Google Scholar ] [ CrossRef ]
- Guo, Z. ; Wan, S. ; Hua, K. ; Yin, Y. ; Chu, H. ; Wang, D. ; Guo, X. Le régime de fertilisation a un effet plus important sur la structure de la communauté microbienne du sol que la rotation des cultures et le stade de croissance dans un agroécosystème. Appl. Ecol du sol. 2020 , 149 , 103510. [ Google Scholar ] [ CrossRef ]
- Kracmarova, M. ; Uhlik, O. ; Strejcek, M. ; Szakova, J. ; Cerny, J. ; Balik, J. ; Tlustos, P. ; Kohout, P. ; Demnerova, K. ; Stiborova, H. Communautés microbiennes du sol après 20 ans de pratiques de fertilisation et de rotation des cultures en République tchèque. Environ. Microbiome 2022 , 17 , 13. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Ville, JR ; Dumonceaux, T. ; Tidemann, B. ; Helgason, BL La rotation des cultures influence de manière significative la composition du sol, de la rhizosphère et du microbiote racinaire du canola ( Brassica napus L.). Environ. Microbiome 2023 , 18 , 40. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Hart, MM; Powell, JR ; Gulden, RH; Dunfield, KE ; Peter Pauls, K. ; Swanton, CJ; Klironomos, JN; Antunes, PM ; Koch, UN M; Trevors, JT Séparer l’effet de la culture de l’herbicide sur les communautés microbiennes du sol dans le maïs résistant au glyphosate. Pédobiologie 2009 , 52 , 253-262. [ Google Scholar ] [ CrossRef ]
- Daniel, CS; Yin, C. ; Hulbert, S. ; Burke, moi; Paulitz, T. Les impacts de l’utilisation répétée du glyphosate sur les bactéries associées au blé sont faibles et dépendent de l’historique d’utilisation du glyphosate. Appl. Environ. Microbiol. 2017 , 83 , e01354-17. [ Google Scholar ] [ CrossRef ]
| Avis de non-responsabilité/Note de l’éditeur : Les déclarations, opinions et données contenues dans toutes les publications sont uniquement celles du ou des auteurs et contributeurs individuels et non de MDPI et/ou du ou des éditeurs. MDPI et/ou le(s) éditeur(s) déclinent toute responsabilité pour tout préjudice corporel ou matériel résultant des idées, méthodes, instructions ou produits mentionnés dans le contenu. |
© 2024 par les auteurs. Licencié MDPI, Bâle, Suisse. Cet article est un article en libre accès distribué selon les termes et conditions de la licence Creative Commons Attribution (CC BY) ( https://creativecommons.org/licenses/by/4.0/ ).
